EL ATOMO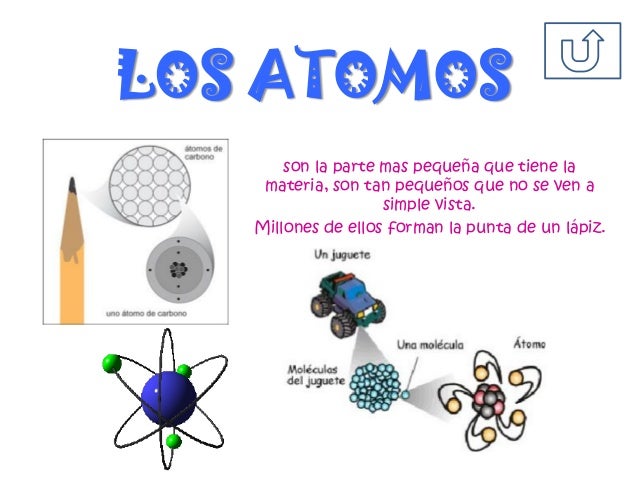

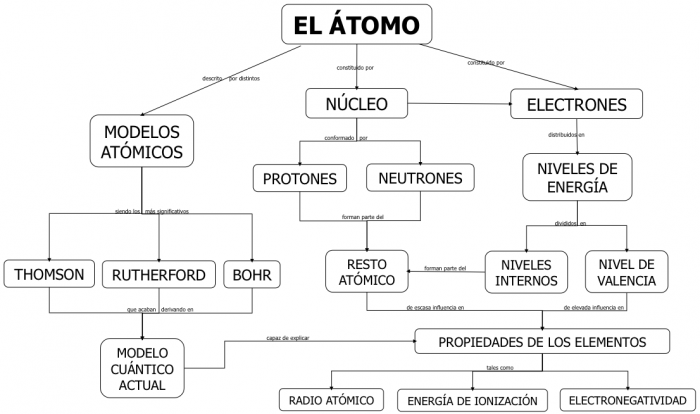
La estructura del átomo
El átomo, que es la unidad básica de composición de la
materia, tiene dos partes claramente diferenciadas: el núcleo y la corteza.
El núcleo es la
zona más interna del átomo, en este dibujo lo tenemos representado en el centro
con colores verdes y rojos.
La corteza, la zona más exterior en el gráfico, lo vemos
representado como una serie órbitas elípticas alrededor del núcleo
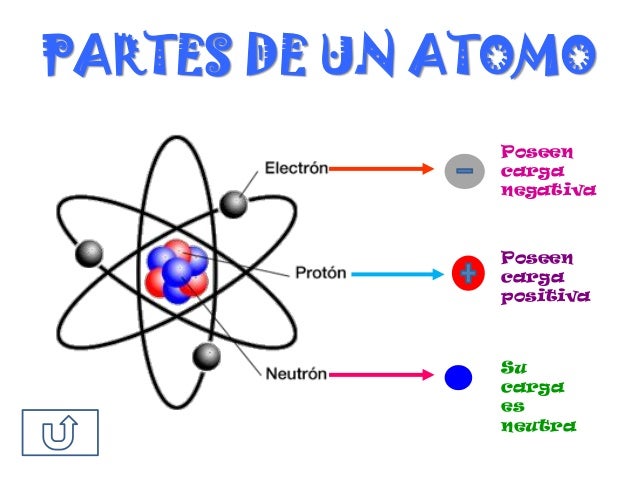
En general, los átomos están compuestos por tres tipos de partículas
subatómicas. La relación entre estas son las que confieren a un átomo sus
características
Por ejemplo, todos los átomos con un protón serán de hidrógeno (Z = 1), todos los átomos con dos protones serán de helio (Z = 2), y así sucesivamente.
Número másico, se representa con la letra A, y hace referencia a la suma de protones y neutrones que contiene el elemento . Dos átomos con el mismo número de protones , pero diferente número de neutrones , diremos que son isótopos.
Los electrones
La configuración electrónica en la corteza de un átomo es la distribución de sus electrones en los distintos niveles y orbitales. Los electrones se van situando en los diferentes niveles y subniveles por orden de energía decreciente LOS ISOTOPOS
Se conoce como isótopo a las variedades de átomos que tienen el mismo número atómico y que, por lo tanto, constituyen el mismo elemento aunque tengan un diferente número de masa. Los átomos que son isótopos entre sí tienen idéntica cantidad de protones en el núcleo y se encuentran en el mismo lugar dentro de la tabla periódica.
El término isotopo tiene su origen etimológico en el griego y es que se compone de dos partes de dicha lengua: isos que puede traducirse como “igual” y topos que significa “lugar”
Cabe destacar que gran parte de los elementos químicos cuentan con más de un isótopo. Apenas veintiún elementos, como el sodio, tienen un único isótopo natural. Es posible dividir los isótopos en isótopos estables e isótopos no estables o radiactivos
Los isótopos de un mismo elemento tienen unas propiedades químicas y físicas muy similares entre sí. Por ejemplo, el proti es el isótopo más abundante del hidrógeno con un solo protón (Z = 1, A = 1) y el deuterio es el isótopo del hidrógeno con un protón y un neutrón (Z = 1, A = 2).
Los átomos neutros tienen el mismo número de protones que de electrones . Así, el hidrógeno (H) tiene un protón y un electrón , y el oxígeno (O) tiene ocho protones y ocho electrones . Cuando arrancamos uno o más electrones de un átomo se forma un ion positivo, o catión ; por ejemplo, al arrancar un electrón del hidrógeno se forma H +.

Cuando se da el proceso inverso, y un átomo adquiere electrones , se forma un ion negativo o anión; por ejemplo, cuando un átomo de oxígeno captura dos electrones se forma el anión O 2
OBSERVAR LOS SIGUIENTES VIDEOS:
https://www.youtube.com/watch?v=kkoY2bAqaWo
https://www.youtube.com/watch?v=kkoY2bAqaWo
No hay comentarios:
Publicar un comentario